EL ÁTOMO

El átomo en la
antigüedad
Los
filósofos griegos discutieron mucho acerca de la naturaleza de la materia y concluyeron
que el mundo era más simple de lo que parecía.
 |
 |
En el siglo V a.
C., Leucipo sostenía que había un sólo tipo de materia y pensaba que si
dividíamos la materia en partes cada vez más pequeñas, obtendríamos un
trozo que no se podría cortar más. Demócrito llamó a estos trozos átomos
("sin división").
La filosofía
atomista de Leucipo y Demócrito podía resumirse en:
1.- Los átomos
son eternos, indivisibles, homogéneos e invisibles.
2.- Los átomos se
diferencian en su forma y tamaño.
3.- Las
propiedades de la materia varían según el agrupamiento de los átomos.
|
 |
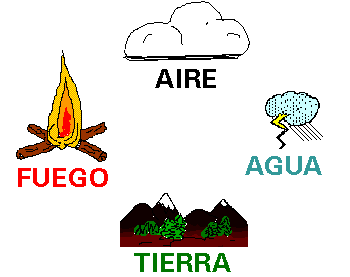
En el siglo IV a.
C., Empédocles postuló que la materia estaba formada por 4 elementos:
tierra, aire, agua y fuego.
 |
|
 |
Aristóteles,
posteriormente, postula que la materia estaba formada por esos 4
elementos pero niega la idea de átomo, hecho que se mantuvo hasta 200
años después en el pensamiento de la humanidad.
 |
|
La teoría atómica de Dalton
En 1808, John Dalton publicó
su teoría atómica, que retomaba las antiguas ideas de Leucipo y de Demócrito.
Según la teoría de Dalton:
1.- Los elementos están formados por partículas
diminutas, indivisibles e inalterables llamadas átomos.
Dalton estableció un sistema para designar a cada
átomo de forma que se pudieran distinguir entre los distintos elementos:
Una vez aceptada la teoría atómica de la materia, los
fenómenos de electrización y electrólisis pusieron de manifiesto, por un lado,
la naturaleza eléctrica de la materia y, por otro, que el átomo era divisible;
es decir, que estaba formado por otras partículas fundamentales más pequeñas.
En Ciencia, un modelo intenta explicar una teoría
mediante una comparación. Un modelo será tanto más perfecto cuanto más
claramente explique los hechos experimentales. El modelo es válido mientras
explica lo que ocurre en los experimentos; en el momento en que falla, hay que
modificarlo.
Modelo atómico de Thomson
El Modelo atómico de Rutherford o
modelo nuclear establece que:
- El átomo tiene un núcleo central en el que están
concentradas la carga positiva y casi toda la masa.
- El núcleo contiene, por tanto, protones en un número
igual al de electrones del átomo.
- Los electrones giran a mucha velocidad alrededor del
núcleo y están separados de éste por una gran distancia.
La composición de los átomos: términos importantes:
 iStockphoto/Thinkstock
iStockphoto/Thinkstock